高中化学平衡移动不会?这份最全知识总结你需要看看!
化学知识点多而零碎,在学习过程中若不能融会贯通,尤其是一些“特殊”之处,往往致使解题陷人“山重水复”之境。为了理解、巩固和掌握这些知识,消除盲点。今天小编给同学们准备了化学平衡相关知识点的总结,赶快来收藏哦!
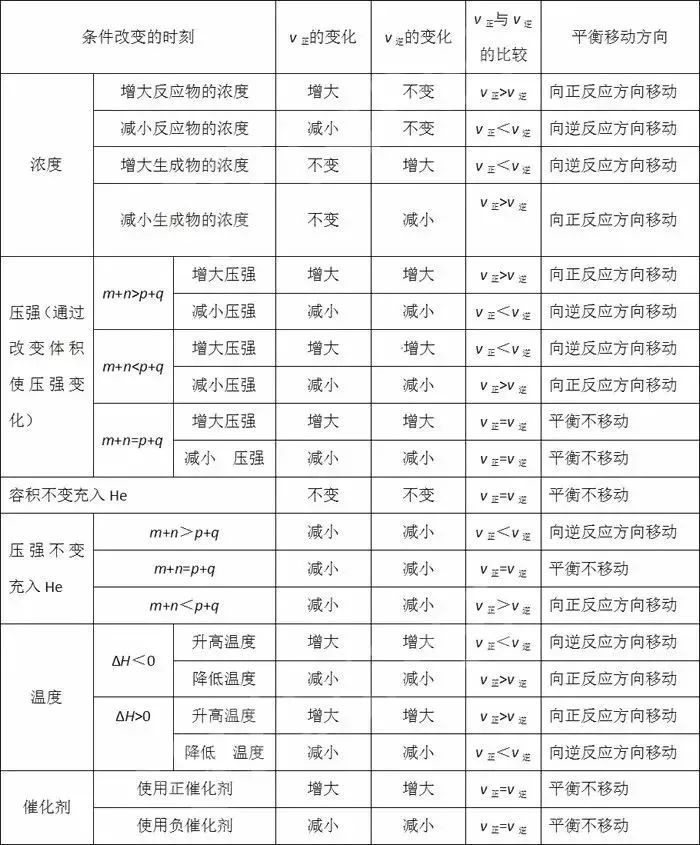
(1)温度:在其他条件不变的情况下,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。
(2)浓度:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,化学平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,化学平衡向应方向移动。
(3)压强:对于反应前后总体积发生变化的化学反应,在其他条件不变的情况下,增大压强,化学平衡向气体体积减小的方向移动;减小压强,化学平衡向气体体积增大的方向移动。
(4)催化剂:由于催化剂能同时同等程度地增大或减小正反应速率和应速率,故其对化学平衡的移动无影响。
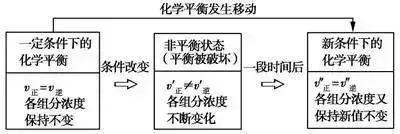
在密闭体系中,如果改变影响化学平衡的一个条件(如温度、压强或浓度等),平衡就向能够减弱这种改变的方向移动。
在一定条件下,浓度、压强、温度、催化剂等因素会影响可应的速率,但平衡不一定发生移动,只有当v正≠v逆时,平衡才会发生移动。
(3)对于反应前后气体体积无变化的反应,如H2(g)+I2(g)2HI(g),压强的改变对平衡无影响。但增大(或减小)压强会使各物质的浓度增大(或减小),混合气体的颜色变深(或浅)。
(4)恒容时,同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响,增大(减小)浓度相当于增大(减小)压强。
(5)在恒容容器中,当改变其中一种气态物质的浓度时,必然会引起压强的改变,在判断平衡移动的方向和物质的率、体积分数变化时,应灵活分析浓度和压强对化学平衡的影响。若用α表示物质的率,φ表示气体的体积分数,则:
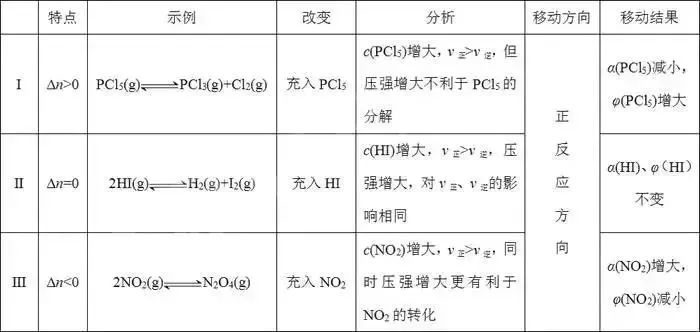
①对于A(g)+B(g)C(g)类反应,达到平衡后,保持温度、容积不变,加入一定量的A,则平衡向正反应方向移动,α(B)增大而α(A)减小,φ(B)减小而φ(A)增大。
②对于aA(g)bB(g)或aA(g)bB(g)+cC(g)类反应,达到平衡后,保持温度、容积不变,加入一定量的A,平衡移动的方向、A的率变化,可分以下三种情况进行分析:
化学平衡图象类试题是高考的热点题型,该类试题经常涉及到的图象类型有物质的量(浓度)、速率—时间图象,含量—时间—温度(压强)图象,恒温、恒压曲线等,图象中蕴含着丰富的信息量,具有简明、直观、形象的特点,命题形式灵活,难度不大,解题的关键是根据反应特点,明确反应条件,认真分析图象充分挖掘蕴含的信息,紧扣化学原理,找准切入点解决问题。该类题型在选择题和简答题中都有涉及,能够很好地考查学生分析问题和解决问题的能力,在复习备考中应引起足够的重视。

(曲线a用催化剂,b不用催化剂或化学计量数a+b=c时曲线a的压强大于b的压强)

(2)恒压(温)线(如图所示):该类图象的纵坐标为物质的平衡浓度(c)或反应物的率(α),横坐标为温度(T)或压强(p),常见类型如下所示:

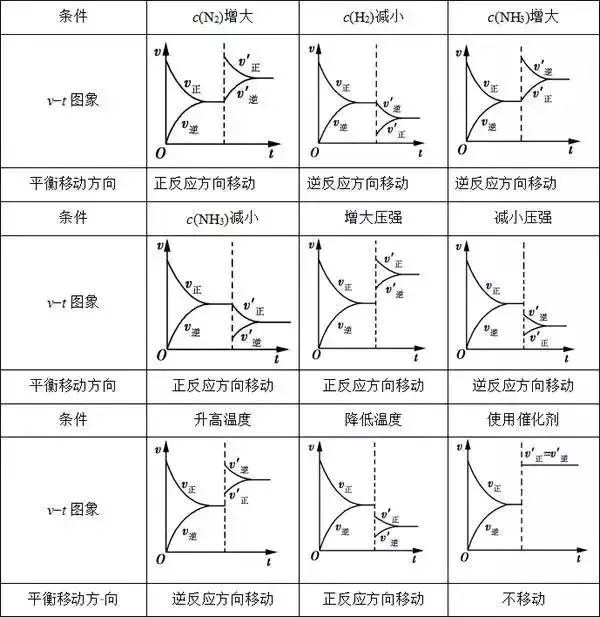
根据v−t图象,可以很快地判断出反应进行的方向,根据v正、v逆的变化情况,可以推断出条件的改变情况。
如下图所示曲线,是其他条件不变时,某反应物的最大率(α)与温度(T)的关系曲线四个点,v(正)v(逆)的点是3,v(正)v(逆)的点是1,v(正)=v(逆)的点是2、4。
在化学平衡图象中,包括纵坐标、横坐标和曲线所表示的意义三个量,确定横坐标所表示的量后,讨论纵坐标与曲线的关系或确定纵坐标所表示的量,讨论横坐标与曲线的关系。如图:
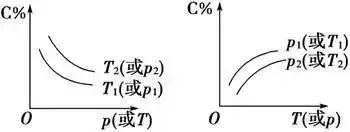
这类图象的分析方法是“定一议二”,当有多条曲线及两个以上条件时,要固定其中一个条件,分析其他条件之间的关系,必要时,作一辅助线)“先拐先平,数值大”原则
在化学平衡图象中,先出现拐点的反应先达到平衡,先出现拐点的曲线表示的温度较高(如图A)或表示的压强较大(如图B)。
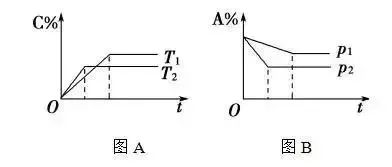
图B表示p1p2,A是反应物,正反应为气体总体积缩小的反应,即a+bc。
(2)对于同一可应,在一定条件(恒温恒容或恒温恒压)下,无论是从正反应(反应物)、应(生成物)或从中间状态(既有反应物、也有生成物)开始,只要建立平衡后,平衡混合物中各组分的比例相同,或各组分在混合物中的百分含量相等,这样的化学平衡互称为等效平衡。
(3)注意只是组分的百分含量相同,包括体积百分含量、物质的量百分含量或质量百分含量,而各组分的浓度不一定相等。
理解等效平衡的意义(1)对于反应前后气体物质的量有变化的反应,如2SO2(g)+O2(g)
容易得出A与C等效,A与D不等效。因为C→D是对反应前后气体体积有变化的反应加压,平衡发生了移动。
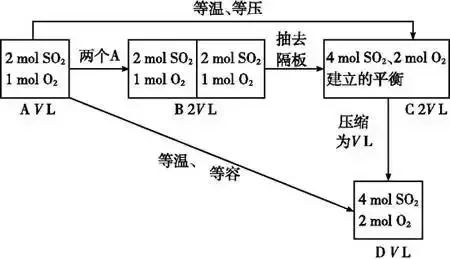
(2)对于反应前后气体物质的量没有变化的反应,如:H2(g)+I2(g)
容易得出A与C等效,A与D等效。因为C→D平衡不发生移动。对反应前后气体体积不变的反应加压,平衡不移动。


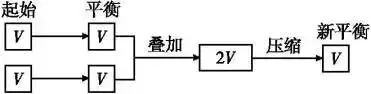
在解题时若遇到比较条件改变后的新、旧平衡间某量的关系有困难时,可以考虑构建一个与旧平衡等效的“虚拟的第三平衡”,然后通过压缩或扩大体积等手段,再与新平衡沟通,以形成有利于问题解决的新模式,促使条件向结论,例如:
(1)构建等温等容平衡思维模式:新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建等温等压平衡思维模式(以气体物质的量增加的反应为例(见图示):新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。

声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。