产后溶血性尿毒症综合征诊治进展
彭雪、吴钊、彭冰,四川大学华西第二医院出生缺陷与相关妇儿疾病教育部重点实验室 四川省医学科学院四 川省人民医院
溶血性尿毒症综合征(hemolytic uremic syndrome, HUS)主要临床表现为“三联征”,即非免疫性(Coombs 实验阴性)微血管病性溶血性贫血、血小板减少和急 性肾功能衰竭[1]。HUS 又根据其病因不同分为“典 型”和“型”两类[1]。产后溶血性尿毒症综合征 (postpartum hemolytic uremic syndrome,PHUS)是 型 HUS 中的一种,与妊娠密切相关,因大部分病例于产 后 10 周内发生不可逆急性肾功能衰竭伴血小板减少、 微血管病性贫血[2],也称为产后自发性肾功能衰竭,发 病率约为 1/25000,少数病例也可于妊娠晚期发生,且 有约 23%的孕妇可继发严重肾脏功能损害[3]。60% ~ 70%的 PHUS 可发展为终末期肾病,预后极差[3, 4 ] 。
2006 年欧洲儿科学组将 HUS 和血栓性血小板减 少性紫癜(thrombotic thrombocytopenic purpura,TTP)两 个不同的临床综合征因其共同的病理基础,均归入血栓 性微血管疾病(thrombotic microangiopathies,TMA)[5]。 典型性 HUS 又叫“腹泻型 HUS”,常见于感染大肠埃希 菌 O157 ∶ H7 的儿童。志贺毒素是导致大肠埃希菌相 关 HUS 血管内皮损伤的主要原因。型性 HUS 被 定义为“一切非志贺毒素感染所致 HUS”,诱因包括如 肺炎链球菌、HIV 病毒等感染性疾病,以及恶性肿瘤、放 化疗、、免疫剂或抗血管内皮生长因子等 药物的使用,还有妊娠、HELLP 综合征、恶性高血 压、免疫系统疾病、遗传因素等。目前研究认为,其发病 的病理生理机制为原发性或继发性补体系统调节异常。 型 HUS 的发病率占 HUS 的 5%~10%,其死亡率在 2%~10%,约 1/3 患者可迅速发展为终末期肾病[1]。
PHUS 是属于型 HUS 中的一种,临床罕见,若未及 时诊断和处理,预后极差。
PHUS 属于型 HUS,目前研究表明 PHUS 的 发病机制可能与以下因素有关。
目前研究已证明,PHUS 与各种原因 诱发补体旁途径(alternative complement pathway)调 节失控、过度激活有关[6, 7 ],若编码补体调节关键蛋白 如 CFH、MCP、CFI、C3 等基因突变或存在相关血浆抗体 如抗补体因子 H 抗体可导致该人群对 PHUS 易感[8]。 诱发因素包括感染、药物、肿瘤、妊娠、子痫前期、母胎输 血、免疫系统疾病等。根据补体基因突变类型可对 PHUS 进行分类为CFH-HUS、MCP-HUS、CFI-HUS、C3-HUS 和抗 补体因子 H 抗体-HUS 等亚型。已知妊娠期母体补体系 统处于应激状态[9],而对于基因缺陷人群其补体激活产 物将持续大量生成,补体异常激活可导致弥漫性血管内 皮损伤、血小板与纤维蛋白聚集消耗、微血栓形成、继发 机械性溶血、终末器官缺血与功能损伤[1, 10]。
研究,PHUS 与遗传因素有关, 儿童 HUS 多为常染色体遗传, HUS 多为常 染色体显性遗传,女性好发。遗传性 PHUS 多伴有恶 性高血压,预后极差。研究发现,妊娠晚期血管性血 友病因子裂解蛋白酶 ADAMTS13(vWF 裂解蛋白酶) 浓度降低或显著降低可明显增加发生 PHUS 和 TTP 的风险[8]。一些 PHUS 患者还存在遗传性 HF1 基因 缺失或 MCP 基因突变[2]。
妊娠期凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅷ、 Ⅸ、Ⅸ及血液中纤维蛋白原等均增加,孕妇血液处于高凝状态。当出现产科合并症或并发症,如妊娠期高血 压、子痫前期、子痫、HELLP 综合征、感染、胎盘早剥、产后 出血、羊水栓塞、弥散性血管内凝血(DIC)等,易导致凝血 功能异常,诱发肾血管痉挛、微血栓形成,严重时导致肾 小管、甚至肾皮质缺血坏死,最终影响肾脏功能。
一些患者发病前可出现胃肠道或泌 尿系统不适症状,有研究者认为细菌毒素或病毒可通 过胃肠道或泌尿道进入机体,引起肾脏血管内凝血反 应。在产褥期,肾脏更易受累,导致 PHUS。 PHUS 的主要病理特征是血管内皮细胞损伤后引 起微动脉和毛细血管内微血栓形成。肾脏是主要受累 器官,活检时显示肾小球毛细血管和小动脉内有广泛微 血栓形成,毛细血管管腔内充满破碎的红细胞和血小板。 微血栓栓子主要由血小板和纤维蛋白组成,可导致靶器 官的缺血梗死。微血栓栓子形成的具体机制可能与血浆 中存在异常的促血小板聚集因子(如 vWF 因子)或缺乏 正常的血小板聚集因子(如前列腺环素等)相关[11]。
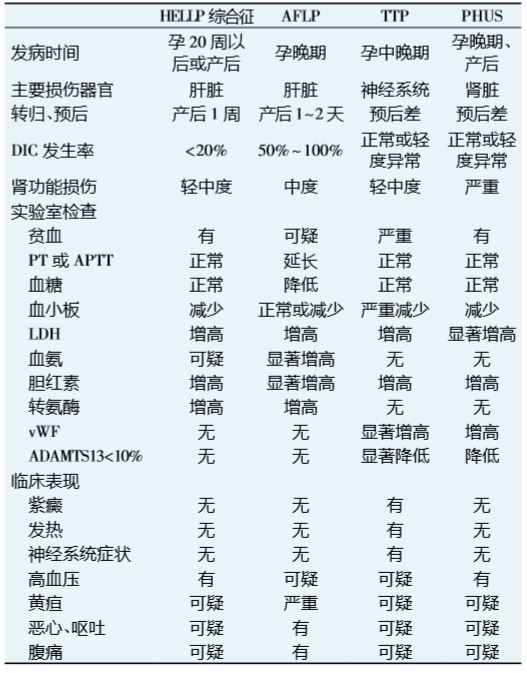
早期诊断和及时治疗可以明显改善 PHUS 患者 预后。但由于 PHUS 与重度子痫前期、HELLP 综合 征、TTP、妊娠期急性脂肪肝(AFLP)等在临床表现上 极为相似,且这些综合征或并发症可能先后发生或相 互重叠,导致临床诊断非常困难。 PHUS 患者主要于妊娠晚期或产后 10 周内发病, 多 数合并有妊娠期高血压、子痫前期、子痫、HELLP 综合征、 感染、胎盘早剥、产后出血等妊娠合并症或并发症。部分 患者在起病前有一系列非性前驱症状,包括恶心、 呕 吐、腹痛、腹泻、发热、头痛、无力等不适,随之出现高血 压、水肿、黄疸,并迅速发展为急性肾功能衰竭。典型者 表现为发热、少尿或无尿、血尿和血红蛋白尿、急剧进展 的氮质血症,同时伴有进行性加重的微血管溶血性贫血 或消耗性血小板减少等,病情发展急剧。少数患者还可 出现肾外表现,包括中枢神经系统症状,如头痛、抽搐、 癫 痫发作、昏迷等,常伴心力衰竭、肺水肿等多脏器衰竭。 实验室检查通常提示:周围血涂片有形态不规则 的破碎红细胞(破碎红细胞比例>1%),网织红细胞增 多;血红蛋白进行性下降,可降至 60 g/L 或更低;血小 板计数<100×109 /L,形态与功能异常;黄疸指数及血 清胆红素增高(以间接胆红素增高为主),乳酸脱氢酶 (LDH)增高,血浆白蛋白降低;纤维蛋白原减少,纤维 蛋白降解产物增高;凝血酶原时间(PT)、凝血酶及活 化部分凝血活酶时间( APTT) 延长;直接或间接 Coombs 试验阴性;血清尿素氮、肌酐升高;肌酐清除率 下降;随机尿出现大量蛋白尿、血尿、病理管型等。 最新研究已证明,PHUS 与各种原因诱发补体旁途径调节失控、过度激活有关,国外文献报道,通过 相关补体基因突变检测发现,近 10%的子痫前期或 HELLP 综合征患者有阳性结果[12],提示 PHUS 极易 被误诊为上述疾病[10],故国外文献推荐对高危人群或 可疑患者应常规开展针对补体旁途径的相关基因 和检测,有助于对该疾病的确切诊断和鉴别诊 断。推荐筛查的具体突变基因包括 CFH、MCP、CFI、 CFB 和 C3 基因,推荐检测的相关包括 vWF、ADAMTS 13、C3 和 C4[13]。例如,血浆中 ADAMTS 13 的 活性检测在 TTP 和 PHUS 的鉴别诊断中非常重要, ADAMTS 13 活性严重降低(<10%)对于 TTP 有极高 的阳性预测值(85%~98%)[14, 15]。 由于目前的实验室检查仅能确诊 40% ~ 75%的 PHUS 患者,且实验室检测需要花费数周甚至数月的 时间,因此 PHUS 的临床诊断更为重要[10, 15]。对于妊 娠晚期或产后数天至 10 周内发生的以微血管病性溶血 性贫血、血小板减少和急性肾功能衰竭为主要表现的患 者,尤其以肾脏损伤为突出表现者,需高度 PHUS, 尽快启动诊断性治疗,同时结合相关实验室检查、 性基因和检测有助于明确诊断与鉴别诊断。 子痫前期、HELLP 综合征等患者通常在终止妊娠后 病情可得到迅速缓解,且上述疾病也是 PHUS 易感人群 的诱发因素之一,如果在终止妊娠 1 周内症状无自限或 好转,且出现肾脏功能进行性损害,结合实验室检查应诊 断 PHUS。具体相关疾病的诊断与鉴别诊断要点见表 1。
目前,PHUS 尚无特效的治疗方法。近年来,国外 研发的性抗补体治疗已对该类疾病的长期治 疗有效。然而,尽早开始血液透析、血浆置换或输注新 鲜冰冻血浆等治疗有助于缓解急性肾脏功能衰竭,可明 显改善 PHUS 患者的预后和提高率,目前仍然是首 选的治疗方法。对 PHUS 的治疗强调多学科团队的综 合治疗和长期随诊,治疗团队应包括母胎医学专家、重 症医学专家、血液学专家和输血医学专家等[13]。
为 PHUS 首选的治疗方法,国外文献推 荐在确诊或疑诊 PHUS 的24 小时内尽早开始透析治疗, 甚至可先于实验室 PHUS 相关基因或检测结果[13]。 有研究认为,腹膜透析因其对血流动力学、心血管系统影 响小,以及可避免肝素化,从而降低腹部切口和子 宫出血的风险,故在 PHUS 治疗中可作为首选[15, 16]。 然而,对少尿或无尿、尿素和肌酐进行性升高、血钾≥ 6 mmol/L、严重代谢性酸中毒、水钠潴留引起心衰、肺 水肿或脑水肿、以及持续性血压升高者应尽早进行血 液透析治疗,使患者更易度过急性肾功能衰竭期[2]。
血浆置换应结合透析治 疗尽早进行,特别针对严重溶血、有出血倾向以及肾 功能严重损害者均为血浆置换的适应证[13]。通过血 浆置换可有效清除血浆里的有害物质、异常补体成分 等,以及及时补充必要的凝血因子和血小板聚集 因子等。具体方法尚无统一标准,但有相关文献推 荐:PHUS 患者置换血浆每次 2~4 L,开始时每天置换 1 次,置换 3~4 次后改为隔日 1 次或每周 2 次直至患 者病情持续稳定[2]。国外文献还推荐为降低输血相 关肺损伤的风险,可选择使用来自男性捐献者的混合 血浆,但尚不充分。血浆置换的治疗方案或时限 应根据患者的治疗效果制定个体化方案,通常应持续 治疗至患者相关血液学指标完全正常,包括血小板恢 复至 150×109 /L 以上,以及 LDH 降至正常水平[13]。 无血浆置换条件也可输注新鲜冰冻血浆,可在一定程 度上缓解病情。具体方法尚无统一标准,但有文献推 荐:初始剂量为400 ml/d,连续使用1~2 周后改为200 ml/d,隔日 1 次,直至病情缓解[2]。严重贫血者可输 浓缩红细胞纠正贫血。
有文献报道[10, 13],肾上腺皮质 激素适合于治疗轻度 PHUS 患者或作为辅助治疗方 法之一,但治疗剂量宜大,如泼尼松每日 1~2 mg/kg, 直至病情缓解,治疗有效率为 10%~50%。
近年来国外 Alexion 公司研 发的人重组单克隆抗体 Eculizumab(商品名 Soliris)是 一种补体性剂,因其对补体介导的血栓性微血管病(TMA)和肾功能改善的有效性,并在诸多 临床前瞻性试验中对患者的明显效益,美国 FDA 和欧洲 CHMP 已批准并推荐其作为一线用药用于治 疗型 HUS[13, 17]。因此,在 PHUS 的诊断性治疗方 案中,抗补体治疗(eculizumab)应尽早开始[18, 19]。但 此药十分昂贵,且需患者长期用药,每人每年需花费 约 409500 美元。该药尚未在中国批准上市,国内亦 无相关文献报道。 4. 5 终止妊娠时机 PHUS 可在妊娠晚期发生,但目 前尚无相关指南或专家共识明确妊娠期患者终止妊 娠的时机,且国内外相关文献极少。国外有学者认 为,妊娠期如诊断型 HUS 应尽快终止妊娠[20]。 妊娠大于 33 周应给予地塞米松促胎肺成熟治疗后, 尽快以剖宫产终止妊娠。妊娠 32~33 周可先进行血 液透析和血浆置换,同时予促胎肺成熟治疗,待病情 改善后行剖宫产终止妊娠。妊娠小于 31 周者应尽快 终止妊娠,同时进行血液透析、血浆置换等治疗。 PHUS 如治疗不及时死亡率极高。由于 PHUS 患 者体内补体系统的持续异常激活和不可逆的肾脏功 能损伤,即使短期内病情已得到有效缓解,但仍需长 期治疗和随访[21]。据统计,PHUS 导致急性肾功能衰 竭患者中有 60%在 1 年内可发展为终末期肾病,甚至 因慢性多器官功能衰竭或并发症导亡[22]。另外, 根据型 HUS 不同亚型的预后研究发现,CFHHUS 预后最差,死亡率高达 20%~50%,CFI-HUS 患者 中有 50%可进展至终末期肾病,而大部分 MCP-HUS 患者的肾脏功能可逆,如果治疗及时,抗补体因子 H 抗体-HUS 亚型的患者预后最佳[3]。